深圳市儿童医院血液肿瘤科文飞球教授、陈小文副研究员等与浙江大学基础医学院纪俊峰教授等团队自2013年在深圳市科创委技术开发项目资助下开始在“低免疫原性全能干细胞向造血干/祖细胞的关键技术研究”等干细胞领域开展科研合作,团队先后在早衰干细胞鉴定和分离,线粒体功能亢进在干细胞衰老中的作用等领域合作发表多篇高影响因子论文。近期团队再次取得重要进展,在Nature子刊Nature Communications在线发表了题为“PHC1 maintains pluripotency by organizing genome-wide chromatin interactions of the Nanog locus ”的重要研究成果。该文陈小文为共同第一作者,文飞球教授为共同通讯作者。
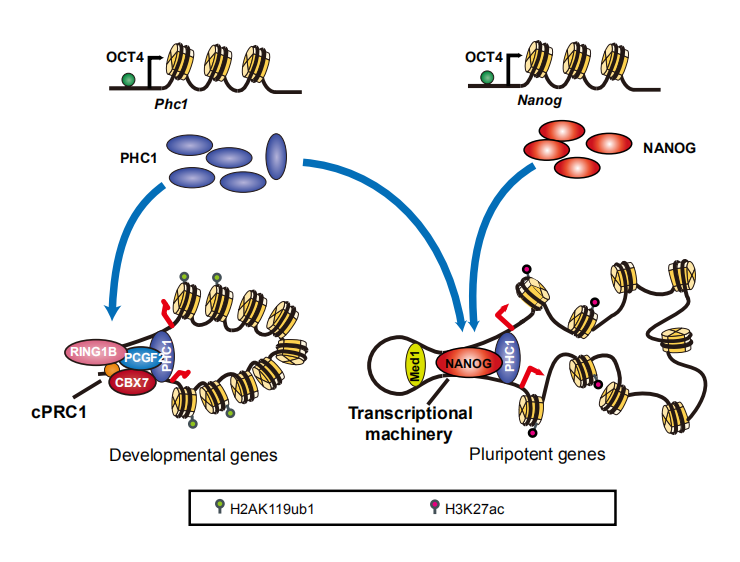
多能干细胞(Pluripotent Stem Cells, PSCs)可以在体外无限自我更新并保持向三个胚层任何细胞类型分化的潜能。包括Oct4,Sox2和Nanog(OSN)在内的核心转录因子通过形成自我调节环路调控多能特异性基因转录网络对于多能性的维持至关重要。多梳家族(Polycomb Group,PcG)蛋白组装成两个主要的多亚基复合物,称为多梳抑制复合物1和2(PRC1和PRC2),通过在发育过程中抑制基因表达来维持细胞身份。新近研究报道许多PcG蛋白在细胞命运决定过程中能直接激活基因表达,但它们调控多能性基因激活的机制仍然知之甚少。本研究显示经典多梳抑制复合物1(cPRC1)的一个亚基Phc1可以通过不依赖于PRC1的方式激活Nanog在多能性维持中发挥作用。Phc1的敲除减少了Nanog的表达,而Nanog过表达则部分地挽救了由于Phc1耗竭而导致的多能性受损。我们发现Phc1与Nanog相互作用并通过稳定Nanog基因座全基因组维度的染色质相互作用来激活Nanog转录。这为既往PRC1组份只通过PRC1依赖性的方式抑制分化基因的表达在多能性维持中发挥已知经典功能增加了新的认识。本研究拓展了我们对PcG介导的基因表达调控的认识。由于PcG蛋白在胚胎发育、细胞周期调控、DNA损伤修复及肿瘤形成过程中都起着非常重要的作用,并且Phc1被鉴定为原发性小头畸形的致病基因,相关分子在神经系统发育和功能维持中可能具有重要作用,明确这些分子调控机制及其异常调控造成神经发育异常及在儿童神经肿瘤中的作用,将为儿童神经遗传及肿瘤性疾病的临床治疗提供新思路。